Tagged: 细胞治疗
In Vivo CAR-T:重塑细胞治疗格局
- 生物医药, In Vivo CAR-T, 细胞治疗, RNA载体, 病毒载体
在过去三十年中,免疫疗法发生了重大变革。自体嵌合抗原受体(CAR)-T细胞疗法表现突出,具有强大的治疗效力——该疗法先采集患者自身的T细胞,对其进行基因改造以使其表达CAR,随后回输患者体内,目前已在多种B细胞恶性肿瘤中展现出治疗潜力。尽管前景可期,但自体或异体基因CAR-T细胞疗法向更广泛适应症及患者群体的拓展速度却低于预期。研究已明确该领域存在多重障碍:包括制造流程复杂、生产能力有限;要求治疗前采用基于化疗的淋巴细胞清除预处理方案;实践中常用的方案药物本身具有毒性;此外,部分患者受复杂的治疗耐药机制影响,导致CAR-T的疗效存在局限性等。体内CAR-T(in vivo CAR-T)细胞工程技术通过在患者体内直接生成CAR-T细胞,有望攻克这些难题。该技术不仅省去了体外细胞处理和复杂环节的需求,还致力于提升临床疗效。
该领域诞生于纳米技术、RNA药物、病毒学与CAR疗法等多个领域的交叉地带,引发了生物制药行业的高度关注。该疗法的核心作用机制在于,利用现货型载体或制剂对体内免疫细胞进行直接原位CAR工程改造。这些经体内工程改造的免疫细胞既可以是T细胞、巨噬细胞、自然杀伤细胞及/或其他已分化为效应细胞的免疫细胞,也可以是具有强大的分化为免疫效应细胞能力的造血干细胞(HSCs)。
目前进入临床开发阶段的两大主流平台,在其载荷与递送策略上存在差异:一种是携带整合型载荷的工程化病毒载体,另一种是携带瞬时表达RNA的脂质纳米颗粒(LNP)。使用整合型载荷的体内CAR技术所产生的免疫细胞群体,能够根据抗原的存在与否及抗原负荷,自行调节其扩增和存续能力——这适用于需要更高效力以实现临床疗效的适应症。依赖瞬时表达、非整合型载荷的技术通过调整给药方案,相对独立于抗原负荷来控制暴露程度(即上调或下调经CAR工程修饰的免疫细胞的数量及其存续时间),这种特性适用于安全性要求更高的适应症。
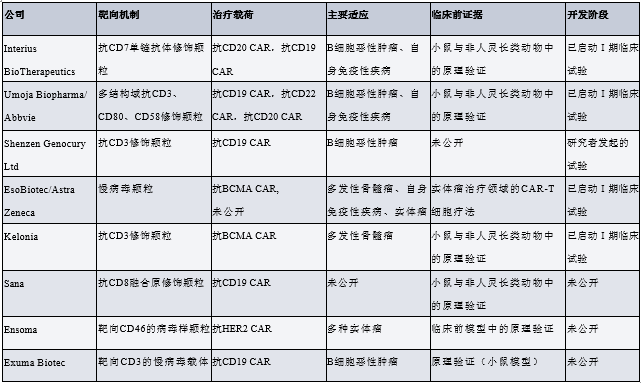
基于病毒载体的平台
该平台依托细胞选择性载体递送,以及通过工程化慢病毒载体或γ-逆转录病毒载体实现的CAR载荷基因组整合。这类病毒载体的一项关键要求是,需实现向患者T细胞的高效选择性基因转移。载体颗粒需避免被非目标细胞摄取,既能保障安全性,又能提升效率。研究人员通过工程改造假型化病毒载体所用的病毒包膜蛋白,来实现这一目标。其设计理念基于两点:一是同时阻断病毒包膜蛋白与天然细胞表面受体的相互作用;二是展示出能识别 T 细胞表面标志物的高亲和力结合剂。
下表所示为 Interius BioTherapeutics、Umoja Biopharma、Shenzen Genocury Ltd、EsoBiotec、Kelonia 及 Sana 等公司研发的、已转化至临床阶段或处于临床前开发阶段的工程化病毒载体(用于 in vivo CAR 治疗)。

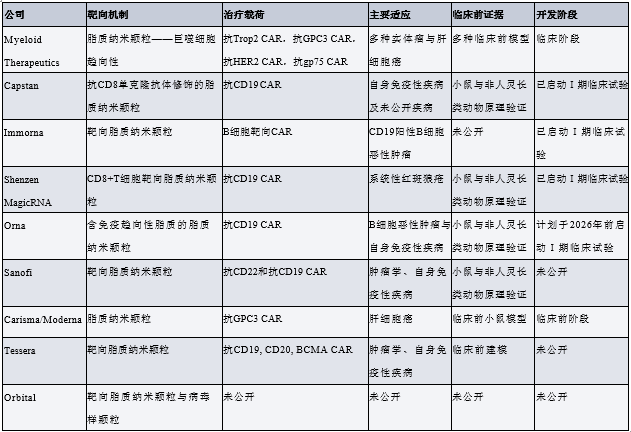
基于 RNA 的平台
基于 RNA 的工程化平台可利用线性 mRNA 或环状 mRNA 实现免疫细胞的瞬时工程化改造,其递送方式包括组织靶向性脂质制剂递送,或经细胞靶向性、抗体功能化的纳米颗粒递送。COVID-19 疫情期间,以脂质纳米颗粒(LNP)为制剂载体的 mRNA 疫苗得以研发推广,这一进展加速了该平台的崛起。与 mRNA-LNP 疫苗中常用的可电离脂质相比,具有高生物降解性和低反应原性的可电离脂质,不仅能满足目标产品的特性要求,还在很大程度上为重复给药提供了可能。抗体功能化的 LNP 可实现对 T 细胞的精准识别;而通过高通量筛选发现的免疫靶向性 LNP,则有助于实现细胞或组织特异性递送。这些 LNP 可用于在体内对 T 细胞亚群或整个淋巴细胞群体进行高效工程化改造。
下表所示为 Myeloid Therapeutics、Carisma Therapeutics、Orna Therapeutics、Capstan Therapeutics、Shenzen MagicRNA、Sanofi、Immorna 等公司研发的、已转化至临床阶段或处于临床前开发阶段的 LNP 载体(用于体内 CAR 治疗)。
自首批 CAR-T 细胞产品获批以来已过去 8 年。如今,展望未来将实现对免疫系统精准且复杂的体内编程。从体外 CAR-T(ex vivo CAR-T)细胞疗法向 in vivo CAR-T 细胞疗法的理念转变,重新定义了免疫疗法的可规模化生产能力与可及性——这一转变因产品成本的大幅降低而成为可能,且具有深远的社会经济意义,将推动救命疗法走向普及化。
佳吾益(北京)科技有限公司拥有高效智能的精准生物药开发平台,拥有覆盖血液肿瘤、实体肿瘤及自身免疫性疾病等疾病领域的在研产品管线。
蛋白表达方面,具备大肠杆菌、昆虫细胞和哺乳动物细胞三大表达体系,通过亲和层析、凝胶过滤层析、离子交换层析和疏水层析等方法进行蛋白纯化,利用 HPLC、SDS-PAGE、和 Western Blot 等手段对蛋白进行质量检测。
抗体发现方面,利用酵母表面展示和抗体人源化技术,高通量筛选抗体文库,获得兼具高亲和力和高特异性的靶向抗原的 scFv,降低免疫排斥反应,改善药代动力学,增加抗体效能。
结合 AlphaFold、MAbpara、CARpara 等模型,对 CAR 表位进行分析预测和定向设计与优化。并与分子、细胞和动物实验相结合,干湿双核驱动 CAR-T 药物研发。
佳吾益(北京)科技有限公司通过自主研发新技术,以解决现有 CAR-T 细胞疗法的挑战,比如提高安全性,提高治疗实体瘤的疗效和降低治疗成本等。结合免疫靶点平台,我们致力于通过专业的技术、高效的沟通以及全面的靶点检测平台为全球范围内的科研及工业客户提供高质量的药物研发服务,帮助客户提高新药研发效率,满足用户对速度、效率和结果的需求。
参考文献
- Bot A, Scharenberg A, Friedman K, Guey L, Hofmeister R, Andorko JI, Klichinsky M, Neumann F, Shah JV, Swayer AJ, Trudeau K, Weissman D, Stephan MT, Buchholz CJ, June CH. In vivo chimeric antigen receptor (CAR)-T cell therapy. Nat Rev Drug Discov. 2025 Sep 30. doi: 10.1038/s41573-025-01291-5.
- Short L, Holt RA, Cullis PR, Evgin L. Direct in vivo CAR T cell engineering. Trends Pharmacol Sci. 2024 May;45(5):406-418. doi: 10.1016/j.tips.2024.03.004.
- Zugasti I, Espinosa-Aroca L, Fidyt K, Mulens-Arias V, Diaz-Beya M, Juan M, Urbano-Ispizua Á, Esteve J, Velasco-Hernandez T, Menéndez P. CAR-T cell therapy for cancer: current challenges and future directions. Signal Transduct Target Ther. 2025 Jul 4;10(1):210. doi: 10.1038/s41392-025-02269-w.
免责声明:本公众号所载内容仅供医学与科研信息交流,不构成任何形式的医疗建议、诊断或治疗推荐。如涉及疾病诊疗问题,请务必遵循专业医师的指导或前往正规医疗机构就诊。本文转载、引用的资料、数据及观点仅代表原作者或来源方立场,与本公众号立场无关。
版权说明:除特别注明外,本公众号原创内容版权归 佳吾益(北京)科技有限公司 所有。未经授权,任何单位和个人不得转载、摘编或以其他方式使用。若涉及版权问题,请及时与我们联系处理。
|编辑:王旭
|责编:张晓莉
|审核:姜威、谷雨

2025诺奖或掀起TCRL-Treg细胞新药研发热潮

来源:诺贝尔奖官网
⚓TCR-Treg:精准免疫调控的新前沿
2025年诺贝尔生理学或医学奖的公布,将调节性T细胞推向了细胞治疗领域的聚光灯下,而TCR-Treg作为其中具有靶向性的治疗策略,正悄然改变自身免疫性疾病的治疗格局。
2025年诺贝尔生理学或医学奖授予了在“外周免疫耐受”领域做出突破性贡献的三位科学家——玛丽·E·布伦科、弗雷德·拉姆斯德尔和坂口志文。他们的研究核心是发现调节性T细胞(Treg),并明确转录因子Foxp3为其身份“开关”。诺奖的肯定促使科学界重新审视Treg细胞在免疫系统中的核心地位。这类“免疫刹车细胞”成为治疗自身免疫性疾病、调控炎症反应的关键角色。
而TCR-Treg技术,正是实现这一精准调控的最前沿策略之一。
01 诺奖启示:Treg细胞的核心地位与治疗价值
在免疫学百年发展历程中,科学家们一直试图解答一个关键问题:免疫系统为何不会攻击自身组织?2025年的诺贝尔奖给出了明确答案——Treg细胞是维持外周免疫耐受的核心。Treg细胞如同免疫系统的“刹车”,能够有效抑制过度的免疫反应,防止免疫系统攻击自身组织。
Treg细胞占CD4+T细胞总数的5-10%,是维持机体免疫耐受和稳态的关键T细胞亚群。它们通过多种机制发挥免疫抑制功能(图1),包括直接抑制效应T细胞、调控抗原呈递细胞功能以及分泌抗炎因子等[1]。Foxp3是Treg细胞的核心转录因子,它通过磷酸化、O-糖基化、乙酰化、泛素化和甲基化五种翻译后修饰调控细胞活性。这些修饰影响Foxp3的稳定性、核定位、二聚化或DNA结合能力,最终决定Treg的免疫抑制功能[2]。
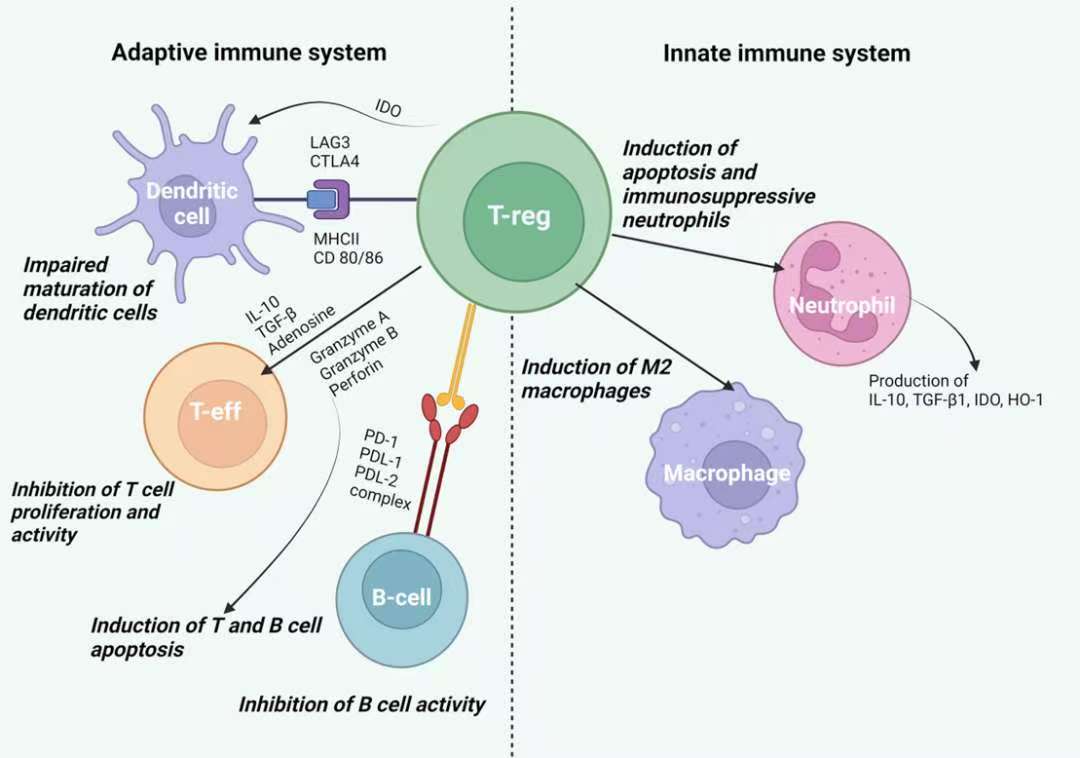
图1:Tregs对先天免疫系统和适应性免疫系统细胞的影响[1]。
02 TCR-Treg技术:原理与突破
TCR-Tregs是经过基因工程改造的调节性T细胞,通过逆转录病毒或慢病毒转导技术,使Tregs表达抗原特异性TCR,从而获得识别特定抗原的能力。与传统多克隆Tregs相比,这种精准靶向的策略代表了过继性细胞治疗的重要进化方向。
抗原特异性是TCR-Tregs的核心优势。研究表明,多克隆Treg在一些疾病如1型糖尿病和代谢综合征疗效较差,在1型糖尿病(T1DM)小鼠模型中,特异性表达胰岛抗原的Treg在阻断疾病进展方面的效率比多克隆Treg有效50至100倍[3]。这意味着过继性细胞治疗(ACT)所需的细胞剂量大幅降低,临床治疗的安全性和有效性显著提升。在临床前研究中,Green等人证实,仅需2000个抗原特异性TCR-Tregs就足以预防NOD小鼠的1型糖尿病。这种“低剂量高效性”的特性使得TCR-Treg疗法相比多克隆Treg疗法更具临床转化潜力[1]。
03 疾病治疗:自身免疫性疾病
TCR-Tregs在多种自身免疫性疾病模型中展现出显著的治疗效果。在系统性红斑狼疮(SLE)研究中,研究人员将Sm特异性TCRs转导至来自抗Sm和HLA-DR15阳性SLE患者的Tregs中。得到的Sm-TCR-Tregs在狼疮肾炎人源化小鼠模型中有效抑制炎症反应并阻遏疾病进展。在1型糖尿病领域,表达胰岛特异性抗原TCR的工程化Tregs在临床前模型中显示出显著优于多克隆Treg的治疗效果[1]。类似地,在多发性硬化症模型中,靶向髓鞘少突胶质细胞糖蛋白(MOG)的TCR-Tregs也能有效控制疾病进展[4]。
04 技术挑战:TCR选择与细胞稳定性
尽管前景广阔,TCR-Treg技术的发展仍面临多重挑战。
寻找合适TCR是首要障碍。需要从患者或健康人中分离、筛选和验证具有正确特异性的天然TCR,过程复杂且耗时。由于外周血中Treg数量有限(仅占CD4淋巴细胞的1-5%),分离特定抗原特异性TCR难度很大。此外,许多Tregs驻留在组织中,进一步增加了分离难度。
TCR错配问题是技术瓶颈之一。在从寻找细胞到分离TCR,再到转导和生产TCR-Tregs的过程中,研究人员面临内源性TCR和转导TCR的α和β链之间的错配问题。这种不当配对不仅降低外源TCR的表达效率,还可能导致自身反应性T细胞产生,带来安全隐患。
TCR亲和力的选择是另一个复杂问题。研究表明,高亲和力和低亲和力TCRs在免疫抑制功能上各有特点:高亲和力TCR的Tregs激活经典免疫抑制通路(如CTLA-4、IL-10)。而低亲和力TCR的Tregs则表达与组织修复相关的蛋白质(如双调蛋白和IL-35)。有趣的是,联合使用高、低亲和力TCR-Tregs比单一类型更能有效抑制疾病活动[1]。
Treg稳定性是临床应用的另一大关切。在炎症环境中,Tregs可能失去FOXP3表达,转化为效应T细胞,反而加剧自身免疫反应。Augusta大学的David Munn团队研究表明,Tregs并非总是稳定,在某些条件下可能失去抑制特性,获得促炎特征,成为“exTregs”[5]。为应对这一挑战,科学家开发了多种稳定Treg表型的策略,包括用全反式维甲酸(ATRA)处理Tregs,异位表达FOXP3基因,以及联合使用CTLA-4过表达、IL-2和抗原刺激等。
05 TCR-Like(TCRL)抗体:解决TCR错配和开发难度的创新策略
面对TCR-Treg技术中的挑战,TCR-Like-Treg(TCRL-Treg)代表了一种突破性的解决方案。佳吾益创始人姜威博士及其斯坦福同事几年前在一篇综述中提到了这种新型细胞疗法(图2)[6]。这种创新策略结合了新型受体的精确性和T细胞的生物学功能,为精准免疫治疗开辟了新途径。
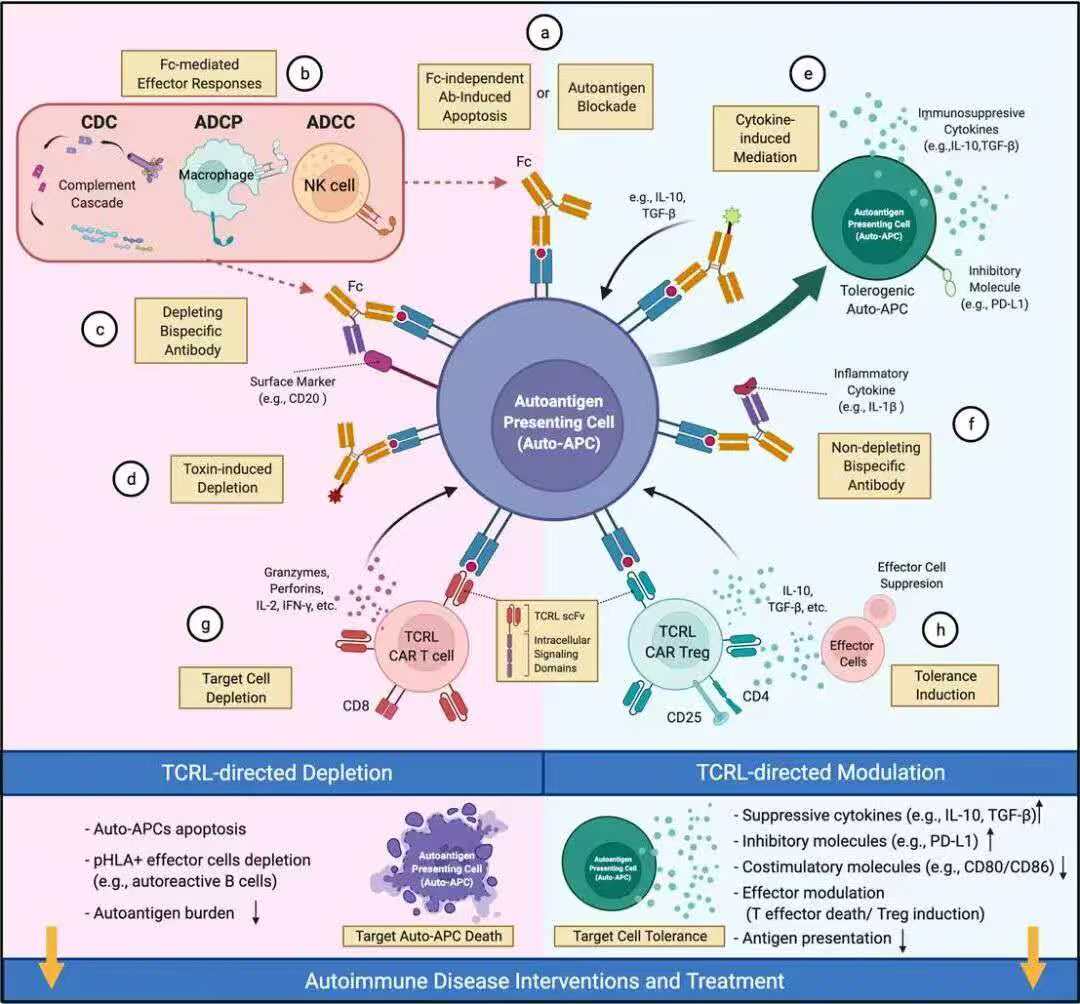
图2:TCRL单克隆抗体在自身免疫性疾病中的治疗潜力[6]。
TCRL抗体(也称为TCRm抗体)是近年来涌现的重要技术,是一类能够识别肽-HLA复合物(pHLA)的工程化抗体。这类抗体具有独特的双重特性:像TCR一样特异性识别HLA-肽复合物,同时又具备传统抗体的高亲和力和稳定性。
TCRL 新型受体是除了 TCR和抗体外的另一种可能,其相关设计涉及到 AI 预测、湿实验验证等重要环节,今年全球多个实验室在相关领域也取得了突破性成果[7-9]。
在结构设计上,TCRL抗体通常采用单链可变片段(scFv)形式,通过噬菌体展示或酵母展示技术筛选获得,能够特异性识别特定的pHLA复合物。将这些抗体与T细胞的信号传导域(如CD3ζ和共刺激分子域)融合,创造出新型的嵌合抗原受体(CAR),进而生成具有特定抗原识别能力的TCR-Like CAR-Treg。
相比于传统TCR-Treg,TCRL-Treg具有多重优势:
开发成本降低:可以利用噬菌体展示、酵母展示等技术直接从抗体库中筛选高亲和力的scFv,技术平台更成熟、通量更高、周期更短、成本更低。
避免链错配问题:由于采用单链抗体设计,完全避免了天然TCR中α链和β链可能发生的错配问题,确保抗原识别特异性。
增强稳定性:抗体结构的稳定性远高于天然TCR,不易发生降解或构象变化,保证长期治疗效果。
可调控亲和力:通过抗体工程技术,可以精确调控TCR-Like抗体对pHLA的亲和力,避免因亲和力过高导致的过度激活或亲和力不足导致的无效识别。
跨HLA限制性应用:通过设计针对不同HLA分子的TCRL抗体,可以在不同遗传背景的患者中使用,减轻了HLA匹配的限制。
06 对比分析:TCR-Treg、TCRL-Treg与CAR-Treg的技术差异
在工程化Treg领域,CAR-Treg是TCR-Treg的主要竞争技术。两者在结构和激活机制上存在显著差异:CAR-Treg应用合成受体识别表面抗原,不依赖HLA分子,使其在不同患者群体中具有更广泛的适用性。CAR通常由单链可变片段(scFv)和细胞内信号域组成,抗原结合后直接激活Tregs。相比之下,传统TCR-Treg依赖T细胞受体,需要特异性HLA-抗原复合物进行激活,这在不同患者群体中可能产生疗效差异,因为TCR必须与患者的HLA类型匹配[1]。而TCRL-Treg则在某种程度上结合了两者的优势:它像CAR-Treg一样使用scFv等嵌合受体避免了天然TCR的低亲和力,使用CAR的强信号通路来激活Treg细胞,信号更强、更直接;同时又像TCR-Treg一样识别pHLA复合物,能够靶向细胞内抗原。
07 创新策略:应对当前挑战的解决方案
面对TCR-Treg技术当前的挑战,科学家们提出了多种创新解决方案:
炎症生物传感器是一种新兴概念。科学家开发了针对炎症介质(如TNFα、TNF样配体1A和肿瘤坏死因子超家族)而非抗原的人工免疫受体(AIRs)。这些AIRs在结构上与CAR-T相似,含有细胞内CD3ζ链和共刺激信号域CD28。Bittner等人证实,AIR介导的 murine Treg激活能引发TCR样信号级联并诱导Treg增殖;更重要的是,AIR-Treg比多克隆Treg更有效。
TCR配对优化是另一个重要研究方向。为解决内源性和转导TCR的α和β链之间的错配问题,科学家采用多种策略,包括内源TCR基因沉默、CRISPR介导的内源TCR基因删除,以及通过在半胱氨酸化α-β恒定链间形成二硫键对转导TCR进行修饰。
TCRL技术的优化包括开发双特异性TCRL抗体,使其能够同时识别pHLA和Treg表面的共刺激分子,增强激活特异性;
细胞重编程技术可解决Treg来源有限的问题。研究表明,CD4+T细胞可通过转导FOXP3和靶向serpin的特定TCR重编程为抗原特异性Tregs。另一种方法是通过TGF-β和IL-2刺激、转基因FOXP3过表达、细胞周期蛋白依赖性激酶8/19(CDK8和CDK19)信号阻断。以及CTLA-4过表达、IL-2和抗原刺激联合使用,将抗原特异性效应T细胞转化为诱导性Tregs。
08 未来展望:TCR-Treg的发展方向与临床转化
随着2025年诺奖对Treg细胞的肯定,TCR-Treg领域预计将迎来快速发展。未来有多个方向值得关注:
稳定性增强是临床转化的首要前提。除了现有的FOXP3稳定策略,代谢调控可能成为新的突破口。通过调控Treg细胞的代谢通路,可能增强其在炎症环境中的稳定性与存活率。
TCRL技术的优化将推动下一代Treg疗法的发展。随着人工智能辅助的抗体设计技术和单细胞测序技术的进步,开发针对特定自身抗原的高特异性TCRL将更加高效。此外,多特异性TCRL的设计能够同时识别多个自身抗原表位,增强治疗效果的广度。
联合治疗策略可能提高疗效。在输注抗原特异性Treg之前,使用减少效应T细胞与炎症的药物可能达到更好的耐受诱导效果。或者通过基因工程改造Tregs,使其能够减少炎症、削弱效应T细胞和促进耐受。
通用型TCR/TCRL-Treg产品开发是降低成本的关键。借鉴癌症治疗中现成通用T细胞的经验,使用基因编辑方法修改异体T细胞。
删除多态性HLA以保护细胞免受宿主免疫系统破坏,并消除其内源性TCR以防止非特异性活性。结合TCRL技术,可以进一步扩大适用患者范围。
随着这些技术的发展,TCR-Treg有望成为自身免疫性疾病、移植排斥甚至神经退行性疾病的革新性治疗方法。
在诺奖的指引下,科学界正在重新绘制免疫治疗的未来图景。TCR/TCRL-Treg代表着这一图景中的关键部分——它不再是简单地抑制免疫,而是精准地重编程免疫系统。
而TCRL-Treg作为这一领域的新星,通过巧妙结合抗体工程的精确性和Treg细胞的生物学功能,为解决传统TCR-Treg的技术瓶颈提供了富有前景的解决方案。
⚓佳吾益:赋能TCRL研发,效率与可控性的双重飞跃
“真核单细胞靶药开发‘芯’工厂”是佳吾益公司自主创建的国际领先的核心技术体系,其创新性在于用高效精准的方法解决精准医疗药物研发的核心难题:周期长、成本高、效率低,成功实现高效筛查验证疾病靶点并根据疾病靶点高效优选生物药候选分子。这套技术可瞄准潜藏在细胞内部的靶点进行靶向药开发,胞内靶点占所有重要靶点的99%以上,但因为其难以被生物药核心组件如抗体或CAR等受体分子识别,国际上鲜有高效的解决该瓶颈问题的底盘技术手段,佳吾益独创的胞内抗原递呈验证及相关新型受体开发技术从根本上解决了这一行业痛点:让酵母展示疾病特有的内部信号,如肿瘤新抗原或免疫系统的识别工具TCRL,直接在单细胞层面鉴定新抗原靶点或优选TCRL药物候选分子。这项全球首创的技术将胞内靶点开发效率提升10倍以上,例如针对肉瘤的精准治疗靶点,仅半年就筛选验证出新抗原并高效开发 TCRL,为个体化癌症疫苗和细胞疗法的研发铺平道路。
🔬佳吾益(北京)科技有限公司——成立于2023年7月,专注于HLA新抗原/TCRL新靶新药与复杂抗原抗体等新靶新药的前瞻性开发,拥有国际首个创新型酵⺟展示底盘技术平台,开发个体化精准治疗产品,首创结合酵母展示技术与免纯化新技术开发苗头新型受体的方法,指导单抗、BiTE/TCE、ex vivo/in vivo CAR、TCRL开发。
关键词:#TCRL新型受体 #TCRL抗体 #调节性T细胞Treg #过继性细胞治疗ACT #自身免疫性疾病
参考文献
- Fisher, Marina S, and Sergey V Sennikov. “T-regulatory cells for the treatment of autoimmune diseases.” Frontiers in immunology vol. 16 1511671. 4 Feb. 2025.
- https://news.medlive.cn/imm/info-progress/show-232485_166.html
- Bluestone, Jeffrey A, and Qizhi Tang. “Treg cells-the next frontier of cell therapy.” Science (New York, N.Y.) vol. 362,6411 (2018): 154-155.
- Kim, Yong Chan et al. “Engineered MBP-specific human Tregs ameliorate MOG-induced EAE through IL-2-triggered inhibition of effector T cells.” Journal of autoimmunity vol. 92 (2018): 77-86.
- https://jagwire.augusta.edu/au-scientists-advance-understanding-of-nobel-winning-immunology-research/
- Li, Ying et al. “TCR-like antibodies targeting autoantigen-mhc complexes: a mini-review.” Frontiers in immunology vol. 13 968432. 27 Jul. 2022
- Liu, Bingxu et al. “Design of high-specificity binders for peptide-MHC-I complexes.” Science (New York, N.Y.) vol. 389,6758 (2025): 386-391.
- Johansen, Kristoffer Haurum et al. “De novo-designed pMHC binders facilitate T cell-mediated cytotoxicity toward cancer cells.” Science (New York, N.Y.) vol. 389,6758 (2025): 380-385.
- Householder, Karsten D et al. “De novo design and structure of a peptide-centric TCR mimic binding module.” Science (New York, N.Y.) vol. 389,6758 (2025): 375-379.
免责声明
本公众号所载内容仅供医学与科研信息交流,不构成任何形式的医疗建议、诊断或治疗推荐。如涉及疾病诊疗问题,请务必遵循专业医师的指导或前往正规医疗机构就诊。本文转载、引用的资料、数据及观点仅代表原作者或来源方立场,与本公众号立场无关。
版权说明
除特别注明外,本公众号原创内容版权归 佳吾益(北京)科技有限公司 所有。未经授权,任何单位和个人不得转载、摘编或以其他方式使用。若涉及版权问题,请及时与我们联系处理。
| 编辑:张晓莉
| 责编:张晓莉
| 审核:姜威、谷雨

