Tagged: CAR-T
胃癌治疗新纪元:瞄准“隐形炸弹”CLDN18.2,CAR-T、ADC等疗法崭露头角
胃癌,尤其是晚期胃癌,长久以来都是医学界面临的严峻挑战。化疗、放疗等传统手段效果有限,患者生存期短。近年来,随着精准医疗的发展,我们终于找到了一个极具潜力的新靶点——Claudin 18.2 (CLDN18.2),它正引领着一场胃癌治疗的深刻变革[1]。
一、谁是CLDN18.2?一个理想的“靶子”
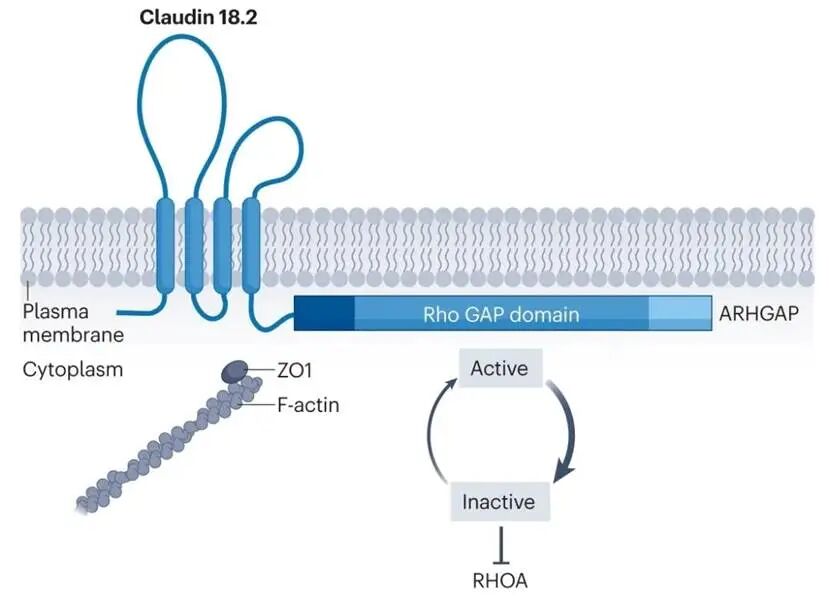
Claudin 18.2并不是一个新发现的蛋白,作为Claudin18蛋白的剪接亚型,它是正常胃黏膜上皮细胞紧密连接中的一种成分,像“水泥”一样把细胞牢牢粘在一起,维持胃组织的屏障功能[1]。

图1: 胃上皮细胞紧密连接结构局部示意图,Claudin18.2 蛋白位于胃上皮细胞间的紧密连接处,是构成紧密连接复合体的关键组分,通过与相邻细胞的 Claudin18.2 分子相互作用,维持细胞间的连接和屏障功能[2,3]。
它的独特之处在于:
表达高度特异性: 在正常人体组织中的表达具有“胃为主、小肠为辅”的高度特异性,并在其他组织中几乎无功能性表达。这意味着靶向它,可能会“误伤”的正常组织非常有限,安全性较高[1]。
在癌变时“暴露”: 当正常胃细胞癌变时,细胞结构发生紊乱,原本深藏的CLDN18.2会大量暴露在癌细胞表面,成为一个醒目的“靶标”[1]。
在肿瘤组织中表达上调: 约38%-86% 的胃癌患者肿瘤组织中都存在CLDN18.2的表达[1,4],这意味着它有望惠及大量患者,远超HER2等传统靶点;此外,CLDN18.2还在乳腺癌、结肠癌、肝癌、头颈癌、支气管癌以及非小细胞肺癌等多种原发恶性肿瘤中异常激活和过度表达。
二、先锋登场:靶向CLDN18.2的单抗药物
任何新靶点的验证,都需要一款“拳头产品”来打开局面。Zolbetuximab 正是这样的先锋[1]。
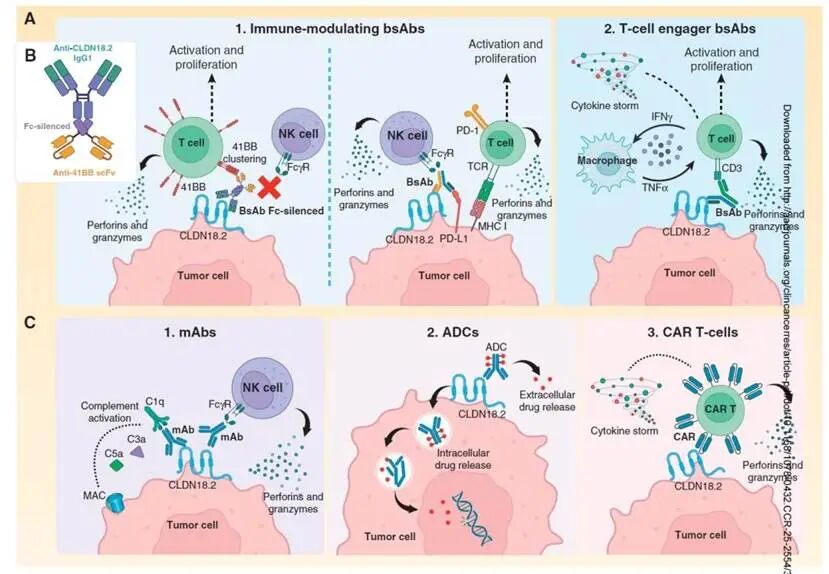
图2: Zolbetuximab 作用机制示意图。Zolbetuximab 抗体呈 Y 形结构,能够特异性识别并结合癌细胞表面暴露的 CLDN18.2 抗原。结合后,Zolbetuximab 的 Fc 段暴露,与自然杀伤细胞(NK 细胞)等免疫细胞表面的 Fc 受体结合,招募 NK 细胞。NK 细胞被激活后,释放穿孔素和颗粒酶等细胞毒性物质,诱导癌细胞凋亡,从而发挥抗肿瘤作用[5]。
作为首款靶向CLDN18.2的单克隆抗体,它本身不直接杀伤癌细胞,而是像“标记笔”一样识别并结合癌细胞表面的CLDN18.2,然后调动患者自身的免疫系统(如NK细胞、巨噬细胞)来攻击癌细胞[1]。
两项关键的三期临床研究(SPOTLIGHT和GLOW)证实,对于CLDN18.2高表达的晚期胃癌患者,在标准化疗基础上联合Zolbetuximab,能显著延长患者的无进展生存期和总生存期[6,7]。基于这些卓越数据,Zolbetuximab已在多国获批上市,标志着CLDN18.2正式成为一个新的、可靶向治疗的分子亚型。
三、群雄逐鹿:下一代靶向疗法百花齐放
单抗的成功只是序章,更多基于CLDN18.2靶点的创新疗法正在临床研究中展现出惊人潜力。
1. “活细胞药物”CAR-T:精准的“定向爆破”
CAR-T疗法在血液肿瘤中已大获成功,如今科学家们正努力将其应用于实体瘤。2019年发表于《JNCI》的这项开创性研究,首次开发了靶向CLDN18.2的CAR-T细胞(例如CT041)[4]。
工作原理: 从患者体内提取T细胞,在体外进行基因改造,装上能特异性识别CLDN18.2的“导航头”(CAR),再回输到患者体内。这些改造后的T细胞就变成了精准的“特种部队”,能高效追踪并清除表达CLDN18.2的胃癌细胞[4]。
临床曙光: 这款由我国科济药业自主研发的CLDN18.2 CAR-T产品CT041,展现了令人鼓舞的疗效。早期临床试验数据表明,对于历经多线治疗失败的晚期胃癌患者,CT041的客观缓解率仍能超过50%,为末线患者带来了前所未有的希望[8]。基于优异的临床数据,CT041已于今年(2025年)6月正式向国家药监局(NMPA)提交上市申请,目前正处于审评阶段。这标志着中国在CAR-T细胞药物治疗实体瘤这一前沿领域,已经走在了世界前列,是名副其实的“中国智造”抗癌新星。
2. “生物导弹”抗体药物偶联物(ADC):高效且具“旁观者效应”
ADCs被誉为“生物导弹”,它由三部分组成:
- 导航系统: 靶向CLDN18.2的抗体。
- 高爆炸药: 强效的细胞毒性药物。
- 连接臂: 将两者稳定连接的化学链。
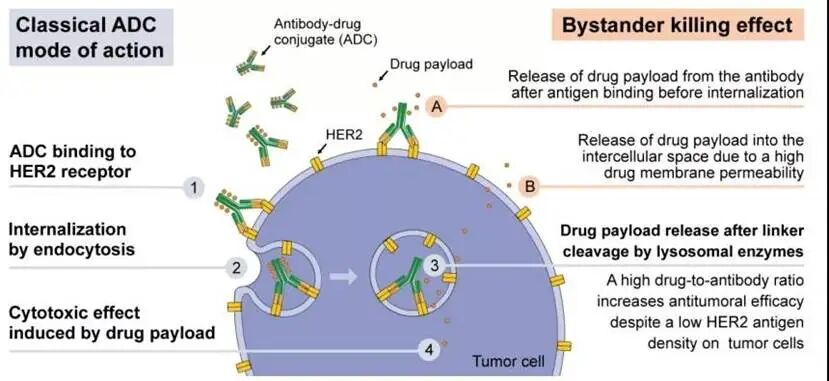
图3: ADC 药物作用机理示意图。ADC 药物由抗体、连接子和细胞毒药物组成。药物进入体内后,抗体部分与肿瘤细胞表面抗原特异性结合,随后 ADC - 抗原复合物被细胞内吞,进入溶酶体。在溶酶体中,连接子断裂,释放出细胞毒药物,毒素干扰细胞关键机制,导致癌细胞死亡。同时,释放的细胞毒药物还可能波及邻近的“旁观者”癌细胞,增强杀伤效果[9,10]。
ADC药物能精准地将高毒性的细胞毒性药物投送到癌细胞内,同时减少对正常组织的伤害。代表药物如CMG901 (AZD0901),在临床试验中,即便对于化疗耐药的患者,也展现了约40% 的客观缓解率[11]。更厉害的是,部分ADC还能产生“旁观者效应”,顺带杀伤附近不表达靶点的癌细胞,克服肿瘤异质性[1]。
3. “双面间谍”双特异性抗体:同时调动两大免疫军团
双特异性抗体结构更精巧,能同时结合两个靶点。针对CLDN18.2,主要有两种设计:
- T细胞衔接器: 一端结合CLDN18.2,另一端结合T细胞表面的CD3。它能将患者体内的T细胞“拉”到癌细胞身边,直接激活并杀伤。
- 免疫调节型: 一端结合CLDN18.2,另一端结合如4-1BB或PD-L1等免疫检查点,旨在打破肿瘤的免疫抑制环境,全面激活免疫攻击[1]。
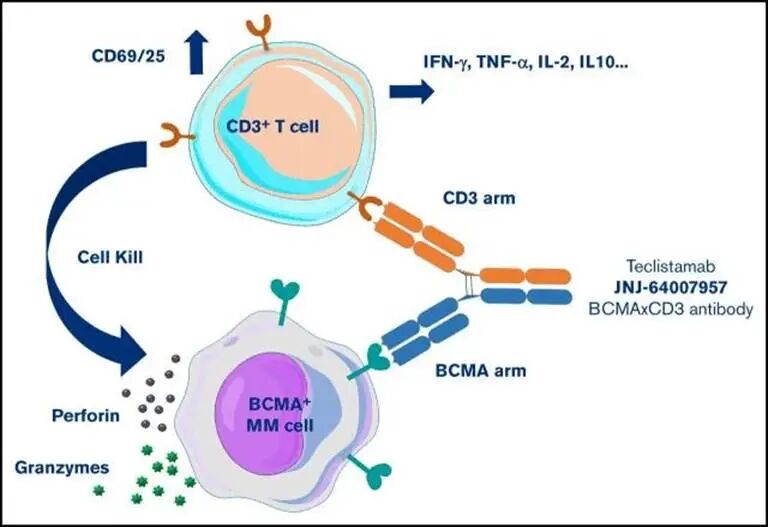
图4: 双特异性 T 细胞衔接器(TCE)的一个 Fab 端结合肿瘤相关抗原(TAA),另一个 Fab 端结合 T 细胞表面的 CD3 受体,将 T 细胞吸引至肿瘤细胞表面,激活 T 细胞并诱导肿瘤细胞杀伤。激活后的 T 细胞通过与肿瘤细胞形成免疫突触裂解肿瘤细胞,同时释放 IFN-γ、TNF-α、IL-2、IL-10 等细胞因子,进一步增强 T 细胞增殖与抗肿瘤效应[12,13]。
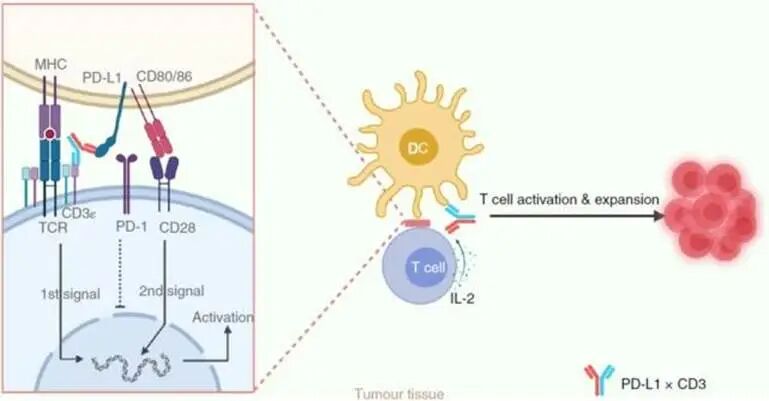
图5: PD-L1×CD3 双抗在肿瘤微环境中连接树突状细胞和 T 细胞,一方面通过 CD3 给予 T 细胞活化的第一信号,另一方面阻断 PD-1/PD-L1 介导的抑制作用。同时,树突状细胞上的 CD80/CD86 会与 T 细胞上的 CD28 结合,为 T 细胞激活提供第二信号,从而使肿瘤组织中的 T 细胞被重新激活,产生有效的抗肿瘤免疫反应[12,13]。
四、展望未来:精准分层与联合治疗
随着越来越多CLDN18.2靶向药物问世,未来的治疗格局将更加精细化。我们可以想象这样一幅图景:
- 对于CLDN18.2高表达的患者,Zolbetuximab联合化疗是标准一线选择[6,7]。
- 对于表达水平中低或后线治疗的患者,更强效的ADC或能调动T细胞的双抗/CAR-T可能更具优势[1,8,11]。
联合治疗是必然趋势,例如CLDN18.2靶向药与PD-1抑制剂的联用,旨在同时提供靶向杀伤和免疫激活,实现“1+1>2”的效果[1]。
结语
从2019年CAR-T的临床前验证[2],到2024年单抗药物成功上市[3,4]及多种创新疗法井喷式发展[1,8,11],CLDN18.2靶向治疗在短短数年内,已将晚期胃癌的治疗推入了一个全新的精准时代。它告诉我们,癌症治疗的未来,不仅限于针对驱动基因,任何癌细胞的“独特印记”都可能成为我们攻击的弱点。
对于胃癌患者而言,进行CLDN18.2的检测至关重要,这将直接决定是否能从这场方兴未艾的靶向治疗浪潮中获益。我们坚信,随着更多研究成果的涌现,征服胃癌的那一天必将更早到来。
免责声明:本文仅为医学科普和信息分享,不能替代专业医疗建议。所有治疗决策请务必与您的主治医生共同商定。
图片版权说明:本文中部分配图来源于已公开发表的学术文献或经授权的专业图库,我们已严格按照学术规范在文内进行引用,版权归原出版方或作者所有。
参考文献
[1] Nakayama, I., Qi, C., Chen, Y. et al. Claudin 18.2 as a novel therapeutic target. Nat Rev Clin Oncol 21, 354–369 (2024). https://doi.org/10.1038/s41571-024-00874-2
[2] Sung H, Ferlay J, Siegel R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71:209 - 249.
[3] Aijaz S, Balda M S, Matter K. Tight junctions: molecular architecture and function[J]. Int Rev Cytol, 2006, 248:261 - 298.
[4] Jiang, H., Shi, Z., Wang, P. et al. Claudin18.2-Specific Chimeric Antigen Receptor Engineered T Cells for the Treatment of Gastric Cancer. JNCI J Natl Cancer Inst 111(4), 409–418 (2019). https://doi.org/10.1093/jnci/djy134
[5] 新靶点、新药物,靶向 CLDN18.2 单抗 Zolbetuximab 获批上市 [EB/OL]. 2024 - 05 - 07. http://www.shurl.cc/a1586766062f892a1c27c2e7a0a63299.
[6] Shitara, K., et al. Zolbetuximab plus mFOLFOX6 in patients with CLDN18.2-positive, HER2-negative, untreated, locally advanced unresectable or metastatic gastric or gastro-oesophageal junction adenocarcinoma (SPOTLIGHT): a multicentre, randomised, double-blind, phase 3 trial. Lancet 401, 1655-1668 (2023).
[7] Shah, M. A., et al. Zolbetuximab plus CAPOX in CLDN18.2-positive gastric or gastroesophageal junction adenocarcinoma: the randomized, phase 3 GLOW trial. Nat Med 29, 2133–2141 (2023).
[8] Qi, C., et al. Claudin18.2-specific CAR T cells in gastrointestinal cancers: phase 1 trial interim results. Nat Med 28, 1189–1198 (2022).
[9] Tsuchikama K, An Z. Antibody - drug conjugates: recent advances in conjugation and linker chemistries[J]. Protein Cell, 2018, 9(1):33 - 46.
[10] Thomas A, Teicher B A, Hassan R. Antibody - drug conjugates for cancer therapy[J]. Lancet Oncol, 2016, 17(6):e254 - e262.
[11] Xu, R.-H., et al. A phase 1a dose-escalation, multicenter trial of anti-claudin 18.2 antibody drug conjugate CMG901 in patients with resistant/refractory solid tumors. J Clin Oncol 41(suppl 4), abstr 352 (2023).
[12] Esfandiari A, Cassidy S, Webster R M. Bispecific antibodies in oncology[J]. Nat Rev Drug Discov, 2022, 21(6):411 - 412.
[13] Nature Biomedical Engineering. Bispecific T - cell engagers for cancer therapy[J]. Nature Biomedical Engineering, 2021.
免责声明:本公众号所载内容仅供医学与科研信息交流,不构成任何形式的医疗建议、诊断或治疗推荐。如涉及疾病诊疗问题,请务必遵循专业医师的指导或前往正规医疗机构就诊。本文转载、引用的资料、数据及观点仅代表原作者或来源方立场,与本公众号立场无关。
版权说明:除特别注明外,本公众号原创内容版权归 佳吾益(北京)科技有限公司 所有。未经授权,任何单位和个人不得转载、摘编或以其他方式使用。若涉及版权问题,请及时与我们联系处理。
|编辑:谷雨
|责编:张晓莉
|审核:姜威

