Tagged: 病毒载体
In Vivo CAR-T:重塑细胞治疗格局
- 生物医药, In Vivo CAR-T, 细胞治疗, RNA载体, 病毒载体
在过去三十年中,免疫疗法发生了重大变革。自体嵌合抗原受体(CAR)-T细胞疗法表现突出,具有强大的治疗效力——该疗法先采集患者自身的T细胞,对其进行基因改造以使其表达CAR,随后回输患者体内,目前已在多种B细胞恶性肿瘤中展现出治疗潜力。尽管前景可期,但自体或异体基因CAR-T细胞疗法向更广泛适应症及患者群体的拓展速度却低于预期。研究已明确该领域存在多重障碍:包括制造流程复杂、生产能力有限;要求治疗前采用基于化疗的淋巴细胞清除预处理方案;实践中常用的方案药物本身具有毒性;此外,部分患者受复杂的治疗耐药机制影响,导致CAR-T的疗效存在局限性等。体内CAR-T(in vivo CAR-T)细胞工程技术通过在患者体内直接生成CAR-T细胞,有望攻克这些难题。该技术不仅省去了体外细胞处理和复杂环节的需求,还致力于提升临床疗效。
该领域诞生于纳米技术、RNA药物、病毒学与CAR疗法等多个领域的交叉地带,引发了生物制药行业的高度关注。该疗法的核心作用机制在于,利用现货型载体或制剂对体内免疫细胞进行直接原位CAR工程改造。这些经体内工程改造的免疫细胞既可以是T细胞、巨噬细胞、自然杀伤细胞及/或其他已分化为效应细胞的免疫细胞,也可以是具有强大的分化为免疫效应细胞能力的造血干细胞(HSCs)。
目前进入临床开发阶段的两大主流平台,在其载荷与递送策略上存在差异:一种是携带整合型载荷的工程化病毒载体,另一种是携带瞬时表达RNA的脂质纳米颗粒(LNP)。使用整合型载荷的体内CAR技术所产生的免疫细胞群体,能够根据抗原的存在与否及抗原负荷,自行调节其扩增和存续能力——这适用于需要更高效力以实现临床疗效的适应症。依赖瞬时表达、非整合型载荷的技术通过调整给药方案,相对独立于抗原负荷来控制暴露程度(即上调或下调经CAR工程修饰的免疫细胞的数量及其存续时间),这种特性适用于安全性要求更高的适应症。
基于病毒载体的平台
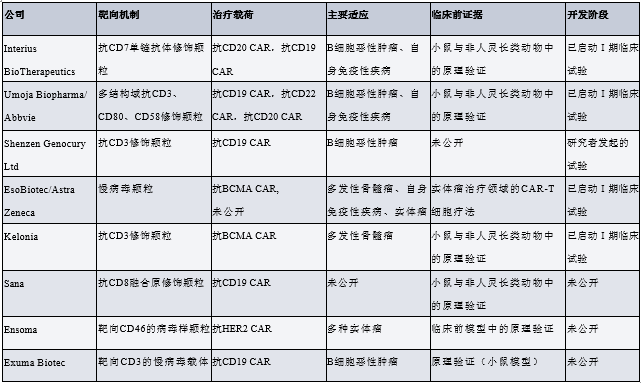
该平台依托细胞选择性载体递送,以及通过工程化慢病毒载体或γ-逆转录病毒载体实现的CAR载荷基因组整合。这类病毒载体的一项关键要求是,需实现向患者T细胞的高效选择性基因转移。载体颗粒需避免被非目标细胞摄取,既能保障安全性,又能提升效率。研究人员通过工程改造假型化病毒载体所用的病毒包膜蛋白,来实现这一目标。其设计理念基于两点:一是同时阻断病毒包膜蛋白与天然细胞表面受体的相互作用;二是展示出能识别 T 细胞表面标志物的高亲和力结合剂。
下表所示为 Interius BioTherapeutics、Umoja Biopharma、Shenzen Genocury Ltd、EsoBiotec、Kelonia 及 Sana 等公司研发的、已转化至临床阶段或处于临床前开发阶段的工程化病毒载体(用于 in vivo CAR 治疗)。

基于 RNA 的平台
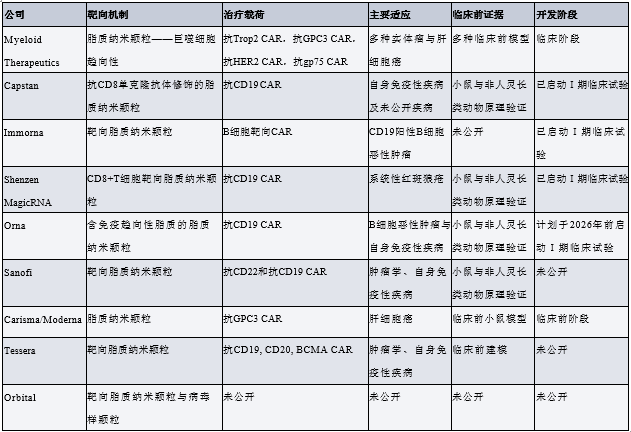
基于 RNA 的工程化平台可利用线性 mRNA 或环状 mRNA 实现免疫细胞的瞬时工程化改造,其递送方式包括组织靶向性脂质制剂递送,或经细胞靶向性、抗体功能化的纳米颗粒递送。COVID-19 疫情期间,以脂质纳米颗粒(LNP)为制剂载体的 mRNA 疫苗得以研发推广,这一进展加速了该平台的崛起。与 mRNA-LNP 疫苗中常用的可电离脂质相比,具有高生物降解性和低反应原性的可电离脂质,不仅能满足目标产品的特性要求,还在很大程度上为重复给药提供了可能。抗体功能化的 LNP 可实现对 T 细胞的精准识别;而通过高通量筛选发现的免疫靶向性 LNP,则有助于实现细胞或组织特异性递送。这些 LNP 可用于在体内对 T 细胞亚群或整个淋巴细胞群体进行高效工程化改造。
下表所示为 Myeloid Therapeutics、Carisma Therapeutics、Orna Therapeutics、Capstan Therapeutics、Shenzen MagicRNA、Sanofi、Immorna 等公司研发的、已转化至临床阶段或处于临床前开发阶段的 LNP 载体(用于体内 CAR 治疗)。
自首批 CAR-T 细胞产品获批以来已过去 8 年。如今,展望未来将实现对免疫系统精准且复杂的体内编程。从体外 CAR-T(ex vivo CAR-T)细胞疗法向 in vivo CAR-T 细胞疗法的理念转变,重新定义了免疫疗法的可规模化生产能力与可及性——这一转变因产品成本的大幅降低而成为可能,且具有深远的社会经济意义,将推动救命疗法走向普及化。
佳吾益(北京)科技有限公司拥有高效智能的精准生物药开发平台,拥有覆盖血液肿瘤、实体肿瘤及自身免疫性疾病等疾病领域的在研产品管线。
蛋白表达方面,具备大肠杆菌、昆虫细胞和哺乳动物细胞三大表达体系,通过亲和层析、凝胶过滤层析、离子交换层析和疏水层析等方法进行蛋白纯化,利用 HPLC、SDS-PAGE、和 Western Blot 等手段对蛋白进行质量检测。
抗体发现方面,利用酵母表面展示和抗体人源化技术,高通量筛选抗体文库,获得兼具高亲和力和高特异性的靶向抗原的 scFv,降低免疫排斥反应,改善药代动力学,增加抗体效能。
结合 AlphaFold、MAbpara、CARpara 等模型,对 CAR 表位进行分析预测和定向设计与优化。并与分子、细胞和动物实验相结合,干湿双核驱动 CAR-T 药物研发。
佳吾益(北京)科技有限公司通过自主研发新技术,以解决现有 CAR-T 细胞疗法的挑战,比如提高安全性,提高治疗实体瘤的疗效和降低治疗成本等。结合免疫靶点平台,我们致力于通过专业的技术、高效的沟通以及全面的靶点检测平台为全球范围内的科研及工业客户提供高质量的药物研发服务,帮助客户提高新药研发效率,满足用户对速度、效率和结果的需求。
参考文献
- Bot A, Scharenberg A, Friedman K, Guey L, Hofmeister R, Andorko JI, Klichinsky M, Neumann F, Shah JV, Swayer AJ, Trudeau K, Weissman D, Stephan MT, Buchholz CJ, June CH. In vivo chimeric antigen receptor (CAR)-T cell therapy. Nat Rev Drug Discov. 2025 Sep 30. doi: 10.1038/s41573-025-01291-5.
- Short L, Holt RA, Cullis PR, Evgin L. Direct in vivo CAR T cell engineering. Trends Pharmacol Sci. 2024 May;45(5):406-418. doi: 10.1016/j.tips.2024.03.004.
- Zugasti I, Espinosa-Aroca L, Fidyt K, Mulens-Arias V, Diaz-Beya M, Juan M, Urbano-Ispizua Á, Esteve J, Velasco-Hernandez T, Menéndez P. CAR-T cell therapy for cancer: current challenges and future directions. Signal Transduct Target Ther. 2025 Jul 4;10(1):210. doi: 10.1038/s41392-025-02269-w.
免责声明:本公众号所载内容仅供医学与科研信息交流,不构成任何形式的医疗建议、诊断或治疗推荐。如涉及疾病诊疗问题,请务必遵循专业医师的指导或前往正规医疗机构就诊。本文转载、引用的资料、数据及观点仅代表原作者或来源方立场,与本公众号立场无关。
版权说明:除特别注明外,本公众号原创内容版权归 佳吾益(北京)科技有限公司 所有。未经授权,任何单位和个人不得转载、摘编或以其他方式使用。若涉及版权问题,请及时与我们联系处理。
|编辑:王旭
|责编:张晓莉
|审核:姜威、谷雨

